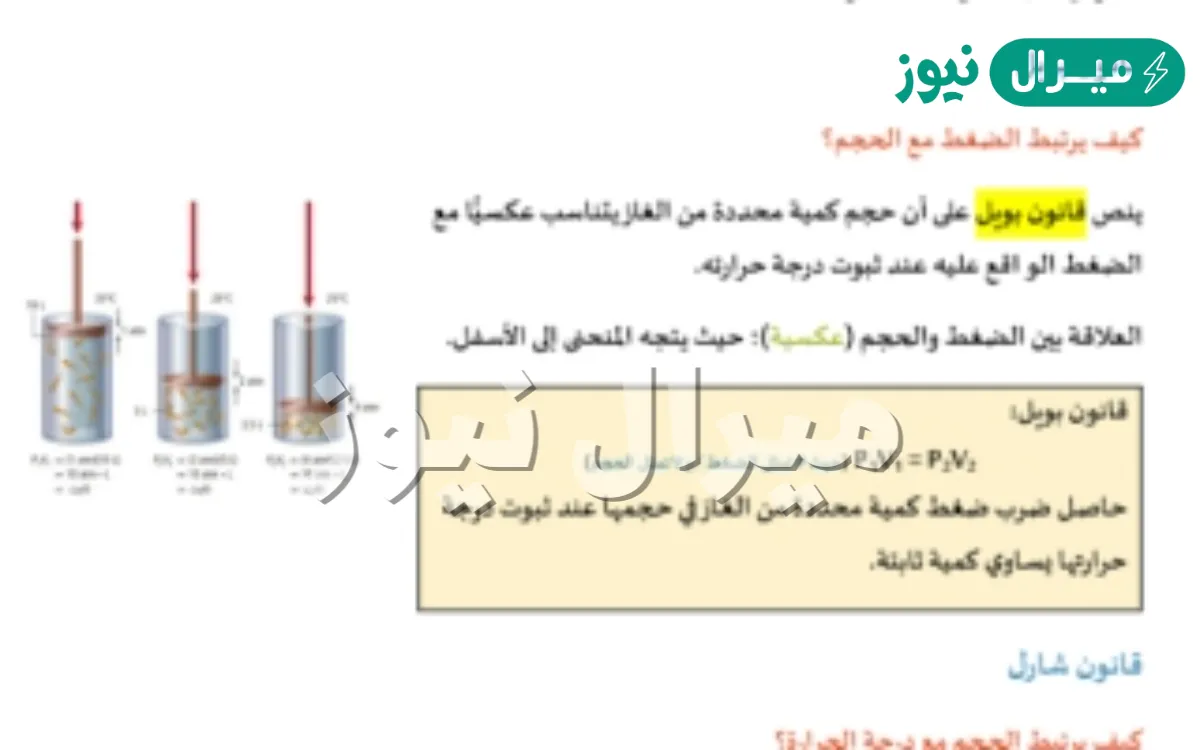
في الفيزياء والكيمياء، هناك قانون أساسي يعرف بقانون بويل، وهو أحد قوانين الغازات المهمة. ينص القانون على أن:

حجم كمية محددة من الغاز يتناسب عكسيًا مع الضغط الواقع عليه، شريطة أن تظل درجة حرارته ثابتة.
بمعنى آخر، إذا زدنا الضغط على الغاز، يقل حجمه، وإذا قل الضغط، يزداد حجمه، طالما أن درجة الحرارة لم تتغير.
التوضيح بالمعادلة:
يمكن التعبير عن قانون بويل رياضيًا كالآتي:
P×V=ثابتP \times V = \text{ثابت}P×V=ثابتحيث:
PPP هو الضغط الواقع على الغاز
VVV هو حجم الغاز
الثابت يعني أن حاصل ضرب الضغط في الحجم لا يتغير عند ثبوت درجة الحرارة
مثال عملي:
إذا كان لدينا أسطوانة تحتوي على غاز حجمه 2 لتر تحت ضغط 1 atm، ثم زدنا الضغط إلى 2 atm مع ثبوت درجة الحرارة، فإن حجم الغاز يصبح:
V2=P1×V1P2=1×22=1 لترV_2 = \frac{P_1 \times V_1}{P_2} = \frac{1 \times 2}{2} = 1 \text{ لتر}V2=P2P1×V1=21×2=1 لتروهذا يوضح أن زيادة الضغط أدى إلى تقليل الحجم إلى النصف.
حجم الغاز وعكس الضغط يتناسبان عكسياً عند ثبوت درجة الحرارة.
هذه الخاصية أساسية في فهم سلوك الغازات وتطبيقاتها في الحياة اليومية، مثل البالونات والمضخات وأنظمة الإطارات.
الإجابة على السؤال: صواب. ✅
