الرابطة التساهمية هي الرابطة التي تدخل ضمن الترابطات الكيميائية، وتتميز هذه الرابطة ومن أهم ما يميز الرابطة التساهمية مساهمة زوج أو أكثر من الإلكترونات بين الذرات، وبالتالي حدوث تجاذب جانبي يساهم في تماسك الجزيء الناتج.

ماهي الرابطة التساهمية
تعد الرابطة التساهمية هي أحد الأشكال الخاصة بـ الترابط الكيميائي، والتي تتميز أنها فيها يتشارك زوج أو أكثر من زوج للذرات حتى يحدث إنتاج للتجاذب فيعمل على حدوث التجاذب للجزئ الذي نتج:
- نجد أن الذرات فيها تكون مائلة إلى المساهمة بإلكتروناتها.
- هذه المساهمة تحدث بالطريقة التي تعمل على جعل الغلاف الإلكتروني الخاص بالرابطة التساهمية ممتلىء.
- نجد دائما أن الرابطة التساهمية أقوي من ناحية القوى بين الجزيئات ومن أمثلتها الرابطة الهيدروجينية.
- يكون حدوث الرابطة التساهمية في الغالب بين الذرات التي تملك سالبية كهربية متشابهة.
- حيث أن هناك طاقة تلزم أن يتم تحريك إلكترون من الذرة.
- تعد الرابطة التساهمية في الغالب ما تحدث بين اللافلزات.
- علي عكس الرابطة الأيونية والتي فيها يكون الارتباط بين الذرات الفلزية والذرات اللافلزية.
- كما أن الرابطة التساهمية دائما ما تكون أقوي من غيرها من الروابط.
- لكن الرابطة الأيونية فيها يكون ترابط الأيونات بقوى كهرساكنة غير موجهة.
- أما الرابطة التساهمية فانها عالية التوجيه.
الرابطة التساهمية الثنائية
تعد الرابطة التساهمية الثنائية والاسم العلمي لها Double covalent bond هي تلك الرابطة المكونة من الاتحاد بين زوجين من الإلكترونات بين الذرتين المرتبطات:
- أشهر الامثلة على الرابطة التساهمية الثنائية ثاني أكسيد الكربون Carbon dioxide، والرمز الكيميائي له CO2.
- بالإضافة إلى غاز الأكسجين Oxygen أما الرمز الكيميائي له O2.
- فالأكسجين يكون على شكل جزيئات ثنائية الذرات.
الرابطة التساهمية الأحادية
نجد أن الرابطة الأحادية بالكيمياء أي الرابطة الكيميائية التي تنشأ بين 2 ذرة، والتي تقوم مع زوج واحد من الالكترونات بالتكافؤ الخارجي من أجل عمل رابطة تساهمية:
- حتى يحدث تشكيل الرابطة التساهمية الأحادية فإن كل ذرة تقوم بتقديم إلكترون تكافؤ يتم خروجه من دائرة المدار الذري، ويكون ضمن دائرة المدار الجزئي للجزئ الذي تم تشكيله.
- من الممكن أن نعبر عن الرابطة التساهمية الأحادية باستعمال أسلوب بنية لويس.
- وفيه يتم الإشارة إلى إلكترون التكافؤ بنقطة مثل AːA، وعندما يتم تشكيل الرابطة يتم الاشارة إليها بشرطة بين الذرتين A-A بهدف التعبير عن الرابطة الأحادية.
الرابطة التساهمية المتعددة
نجد أن الرابطة التساهمية المتعددة تكتسب الذرات في العديد من الجزيئات الالكترونية للغاز النبيل، وهذا يحدث عند اشتراك أكثر من زوج من الإلكترونات والاتحاد مع ذرة أخرى أو أكثر من ذرة:
- حدوث المشاركة بين أكثر من زوج من الإلكترونات أمر ينتج عنه الروابط التساهمية المتعددة.
- ونجد أن الروابط التساهمية الثنائية والثلاثية أفضل الامثلة على هذا.
- أما عن عدد إلكترونات التكافؤ التي تكون ذرة العنصر في حاجة إليها للوصول لحالة الثمانية فإنه مساوي لعدد الروابط التساهمية التي من الممكن أن تتكون.
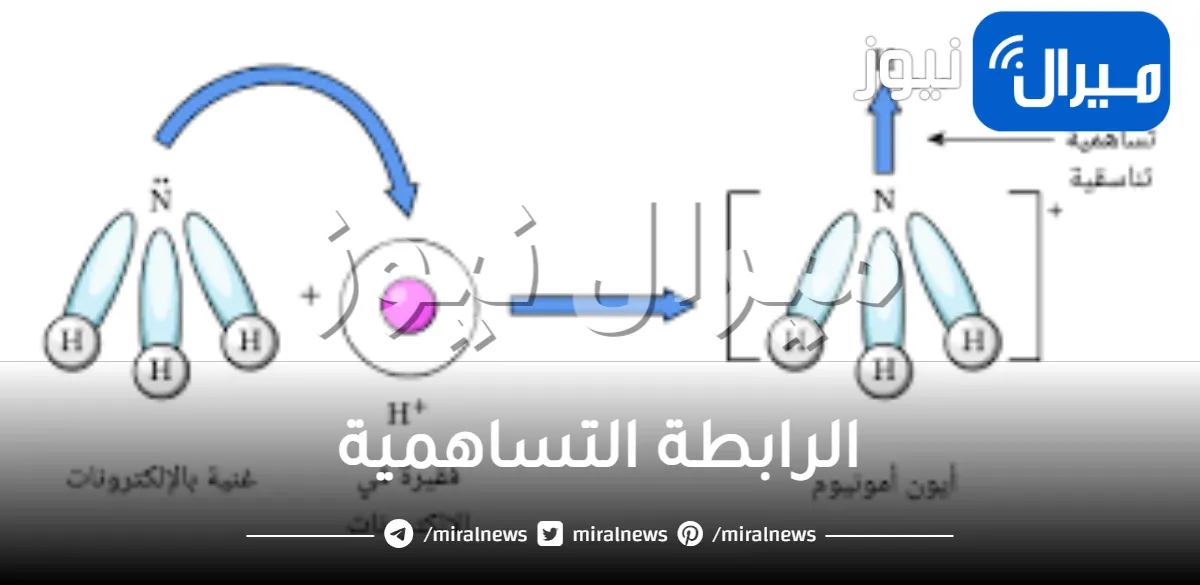
الرابطة التساهمية التناسقية
يطلق عليها الرابط التناسقية أو الرابطة التساندية أو الرابطة التساهمية التناسقية:
- نجد أن الرابطة التساهمية التناسقية هي الرابطة التي تتكون من اتحاد أو تساهم ذرة مع أخرى، حيث يتحد زوج من الإلكترونات التي لا تشترك بالروابط.
- أما الذرة التي تقدم زوجا من الإلكترونات يطلق عليها أسم الذرة المانحة.
- لكن الذرة الأخرى يطلق عليها الذرة المستقبلة، وهي تلك الذرة التي تعمل على تقديم مدارًا فارغًا.
- الرابطة التساهمية التناسقية تنشأ بين الذرات حتى يحدث تكوين الجزيئات.
- ايضا الرابطة التساهمية التناسقية تنشأ بين ذرة في جزيء وأيون، أو أحيانا تنشأ بين ذرة في جزيء وذرة في جزيء آخر.
- ومن أشهر الأمثلة على الرابطة التساهمية التناسقية هي الرابطة في أيون الهيدرونيوم.
الروابط التساهمية الثلاثية Triple Covalent Bonds
نجد أن الروابط التساهمية الثلاثية Triple Covalent Bonds يكون تكوينها عند اشتراك 2 ذرة في 3 زوج من الإلكترونات فيما بينهما:
- نجد أن النيتروجين N2 الثنائي الذرات يكون محتوي على رابطة تساهمية ثلاثية.
- أما كل ذرة من ذرات النيتروجين نجد أن بينها اشتراك في 3 إلكترونات.
- فبالتالي حدوث تكون رابطة تساهمية ثلاثية مع ذرة نيتروجين أخرى.
