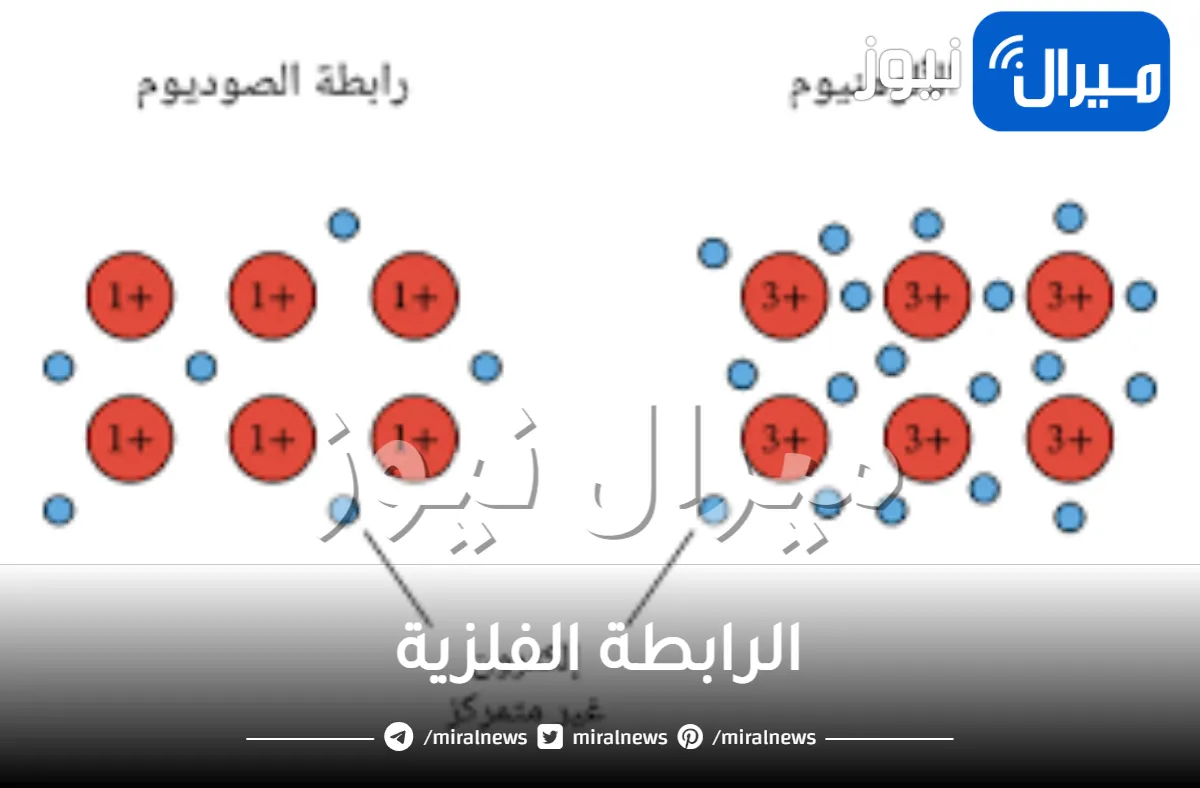
الرابطة الفلزية هي تلك الرابطة الكيميائية، والتي تحدث فيما بين 2 من عناصر الفلزات، وتعد هذه الرابطة هي قوة الجذب الكهربائي الذي ينتج بين الأيونات الموجبة مع الالكترونات السالبة كما أنها تربط البلورة الفلزية كاملة، وعند الارتباط بين الفلزات لا تكتسب التركيب الإلكتروني للغازات النبيلة.

خواص الفلزات
يوجد العديد من الخواص للفلزات، وخواص اللافلزات ومن بينها:
خصائص الفلزات:
- نجد أن الفلزات في الغالب تكون لها بريق، ولمعه، وكثافتها عالية، ومن الممكن سحبها، وطرقها، وفي الغالب لها درجة انصهار عالية.
- الفلزات صلبة، وتعتبر جيدة في التوصيل بالكهرباء والحرارة.
- خاصية التوصيل بالكهرباء والحرارة للفلزات في الغالب تحدث لأن كل ذرة يكون فيها إلكترونات، وهذه الإلكترونات غير مرتبطة بالشكل الجيد بغلافها الأخير إلكترون تكافؤ.
- لذا فنجد أنها تشبه السحابة من الإلكترونات المحيطة بنواة الفلز.
- أغلب الفلزات تكون غير ثابتة من الناحية الكيميائية، ونجدها تتفاعل مع الأكسجين بالهواء حتى تتكون أكاسيد مع الوقت.
- لذا نجد أن الحديد يصدأ مع مرور السنين عليه.
- كما أن البوتاسيوم فقط في ثواني يحترق، والفضة من الممكن أن تفقد اللمعان الموجود فيها مع الوقت.
- نجد أن العديد من الفلزات قد تبدأ في تكوين طبقة ساترة تكون هذه الطبقة من الأكسيد على السطح، وقد تخترقها جزيئات الأكسجين.
- من هذه الفلزات الألومنيوم والتيتانيوم، و تتميز باحتفاظها باللمعان لفترات.
خصائص اللافلزات:
- تعتبر اللافلزات مميزة بأنّها عالية السالبيّة الكهربيّة.
- كما أننا نجد أن اللافلزات مفتقرة للبريق المعدني الموجود بالفلزات.
- يحدث لها الانصهار عند الوصول إلى درجات حرارة منخفضة بشكل نسبي.
- كما تعد اللافلزات من العناصر الغير قابلة سواء للطرق أو السحب أي عكس الفلزات.
- لا يمكن أن يحدث التوصيل الحراري في اللافلزات.
- لكما أنه من المستحيل أن تصدر اللافلزات الرنين.
- بالإضافة إلى أنه تتفاوت حالات المادة بها بين الصلبة والسائلة والغازيّة.
الفرق بين الرابطة الفلزية والايونية
يمكننا التعرف الان على الفروق بين الرابطة الفلزية والأيونية، وما هي الخطوات الثلاثة التي تتم لتكوين الرابطة الايونية:
الرابطة الأيونية:
- تعتبر الرابطة الأيونية هي تلك الرابطة التي تكون نشأتها بين ذرتين غير متشابهتين من ناحية القدرة على الفقد والكسب للالكترونات.
- فنجد الرابطة الأيونية تتكون بين أيوني الذرتين الموجب والسالب، ونتيجة لهذا الترابط ينشأ قوة جذب كهربائي بين كلا من الذرتين.
- اختلاف الذرتين في القدرة على الفقد، أو الاكتساب للايونات كحاجة ذرة الاكسجين لايونين من البوتاسيوم حيث أن المدار الأخير للأكسجين بحاجة لالكترونين للوصول الي الاستقرار.
- في الغالب تكون هذه الرابطة الايونية بين الفلزات ذات الطاقة الأيونية المنخفضة والمائلة إلى فقدان الإلكترونات، واللافلزات المائلة الي اكتساب الالكترونات.
3 خطوات لتكون الرابطة الايونية:
- في البداية يحدث فقد المعدن أو الفلز للإلكترون النشط، والذي يكون أكثر في البعد عن النواة، والذي يفقد قوة جذبه الي أن يصبح الفلز موجب الشحنة .
- بعدها تأتي الخطوة الثانية لتكون الرابطة الأيونية، والتي تكون مع اكتساب اللافلز لهذا الإلكترون فبالتالي يكون اللافلز سالب الشحنة.
- أما الخطوة الاخيرة هي حدوث التجاذب بينهما والذي يطلق عليه التجاذب الكهروستاتيكي ويكون بين الأيون الموجب والأيون السالب.
الرابطة الفلزية:
- تعتبر الرابطة الفلزية هي تلك الرابطة التي تختص بالربط بين عنصرين من الفلزات.
- تكون الرابطة الفلزية مكونة من قوة التجاذب الكهربي الناتج بين الإلكترونات السالبة و الأيونات الموجبة برابطة فلزية.
- وبالنسبة لتلك الروابط فانها موجودة بالبلورات الفلزية المعدنية .
العناصر التي لا تكون روابط فلزية هي
اللافلزات تقوم باكتساب الإلكترونات أو تتشارك بها عند حدوث تفاعل مع العناصر والمركبات الكيميائية ، ويوجد 17 عنصر مصنف أنه من غيرُ الفلزات:
- الهيدروجين.
- الهيليوم.
- النيتروجين.
- الأكسجين.
- الفلور.
- النيون.
- الكلور.
- الأرجون.
- الكريبتون.
- الزينون.
- الرادون.
- البروم.
- بعض المواد الصلبة المتمثلة في (الكربون بالإضافة إلى الفوسفور والكبريت بجانب السيلينيوم وايضا اليود).
- كما أنه في الكثير من الأحيان يتم التُعامل مع الفلزات مثل البورون والسيليكون والجرمانيوم أنها لا فلزات.
اسئلة عن الرابطة الفلزية
يمكنك الاجابة على بعض أسئلة أكمل في الروابط الفلزية، ومنها ما يلي:
- يتم الارتباط في الرابطة الفلزية بين…
- الرابطة الفلزية تعني قوة التجاذب بين الكاتيون و….
- الفلزات تتميز بقابلية الطرق والسحب و….
- تتميز الفلزات بالمتانة …..
